细胞冻存和复苏是细胞培养中的关键环节,直接影响细胞存活率和活力,关系到后续细胞实验能否按照计划有效地进行。要想做好细胞冻存和复苏,首先请牢记下面这四个字:
慢冻快融!
慢冻快融!
慢冻快融!

如果在冻存液中加入保护剂 (如 DMSO),可使冰点降低,增加细胞渗透压稳定性。减缓慢速降温过程中的脱水皱缩现象,在缓慢冻结时减少冰晶的生成,使细胞免受损伤[1]。

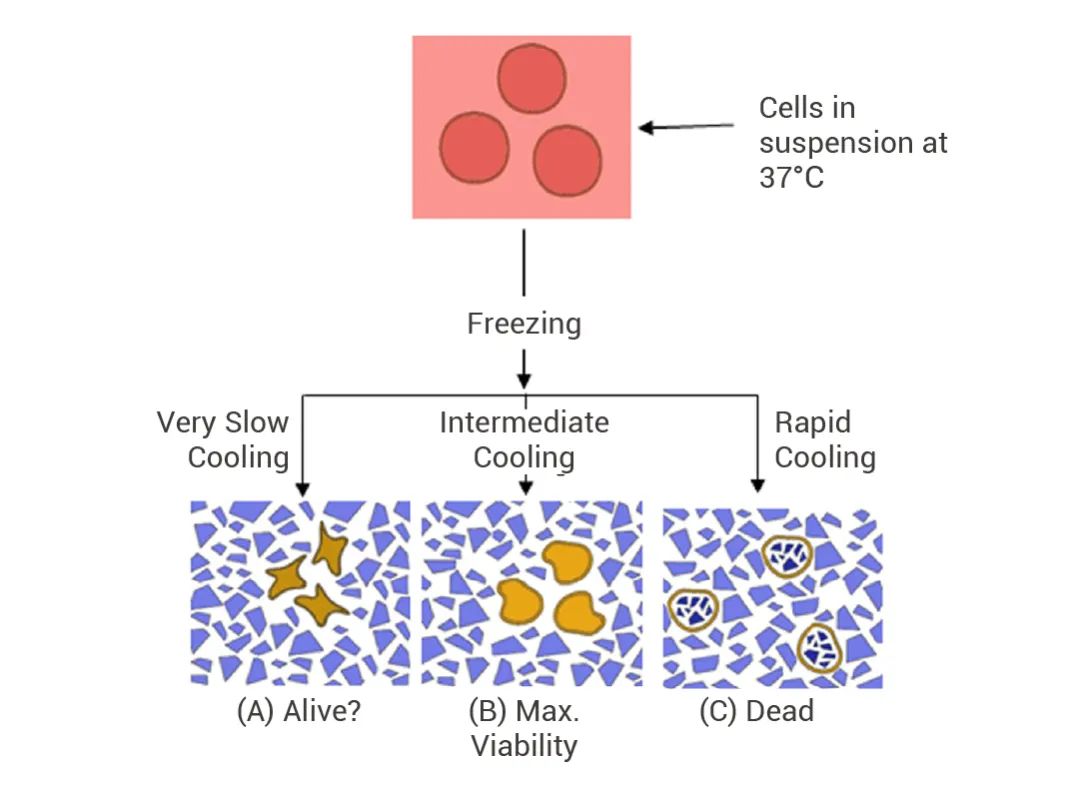
图 1. 不同冷却速度对细胞存活率的影响。
而在复苏时,需要快速升温,在 1-2 min 内融化并稀释,这时细胞内外还来不及形成较大的冰晶,也不会使细胞长时间暴露在高浓度的电解质溶液中,从而避免细胞损伤,提高细胞存活率。往期小 M 还为大家介绍了细胞冻存和复苏的步骤 (详见往期推文:产品上新丨MCE 无血清无蛋白细胞冻存液)。
了解了慢冻快融的原理,还有哪些 Tips 可以提高冻存和复苏的成功率呢?一起来看看小 M 为大家准备的避坑指南吧!



■ 细胞拿取
(注意:从液氮中取细胞时要佩戴护目镜和手套,谨防冻伤及冻存管爆炸!)
a) 解冻细胞时需要快速升温 (50~100℃/min) 才能最大保存细胞活力,最优的解冻方式是 37℃ 水浴[3]。从液氮或 -80℃ 取出冻存的细胞后,稍拧松管盖,防止解冻过程中冻存管炸裂。放入 37℃ 水浴中,持续摇晃 1-2 分钟直至解冻。
通常建议在可见冰融化但样品仍然冰冷(~0℃)时立即停止解冻,常见的做法是在只剩下一小片冰时从水浴锅中取出样品。升温至室温或更高温度会增加冷冻保护剂的细胞毒性,这会极大影响细胞活力[1]。
b) 不建议室温解冻细胞,因为这会导致细胞死亡。
■ 稀释
■ 换液
依据细胞状态,在细胞贴壁后或 24 h 后换液,继续培养。

 Q:为什么我复苏的细胞完全不贴壁?
Q:为什么我复苏的细胞完全不贴壁?
A:可能是由于细胞冻存前生长状态差或者复苏过程中动作慢,因此一定要挑选生长状态良好、处于对数生长期的细胞进行冻存,操作过程要遵循“慢冻快融”的原则!
 Q:为什么我复苏细胞的时候明明已经贴壁了,第二天再去看发现细胞全死了?
Q:为什么我复苏细胞的时候明明已经贴壁了,第二天再去看发现细胞全死了?
A:可能是细胞冻存之前消化过度,导致细胞凋亡,因此消化细胞时一定要严格控制消化时间哦!
 Q:细胞复苏后只有非常少量细胞贴壁,是不是需要重新复苏?
Q:细胞复苏后只有非常少量细胞贴壁,是不是需要重新复苏?
A:先不要着急丢掉!可以补加血清和细胞因子,或者每隔 2-3 天换新鲜的生长培养基,经过 2-3 次换液后,大部分细胞就能看到明显增殖,此时再按照正常传代操作即可。当然,如果细胞库存充足,或者着急做实验,可以重新复苏一株细胞~
 Q:冻存液配多了,不想浪费,可以留到下次用吗?
Q:冻存液配多了,不想浪费,可以留到下次用吗?
A:配好的冻存液在 4℃ 可以暂存 1 周,在 -20℃ 最多可保存一个月。不过最好还是现配现用、避免反复冻融。

|
Penicillin-Streptomycin (100×), Sterile 是已过滤除菌,可直接用于细胞培养的双抗溶液 MCE 特级胎牛血清 (Fetal Bovine Serum) 来源于非疫区健康牛 (不含 BVDV、PI3、IBR、BTV 等牛源病毒),由剖腹产 5-8 月龄胎牛的血液制备而成。 |
|
DMEM (High Glucose, L-Glutamine, Pyruvate, Phenol Red, no HEPES), DMEM (Dulbecco’s Modified Eagle Medium) 是广泛使用的基础培养基,适于培养多种哺乳动物细胞,包括 Hela、293、Cos-7、PC-12 等细胞系,以及原代成纤维细胞、神经元、神经胶质细胞、人脐带静脉内皮细胞、平滑肌细胞等。 |
|
MCE 无血清无蛋白细胞冻存液是一种非程序性即用型细胞冻存液。该产品既适用于常规哺乳动物细胞的冻存,也适用于无血清培养细胞的冻存。 |
|
MCE BM-Cyclin 主要成分为延胡索酸泰妙菌素(Tiamulin fumarate)和盐酸米诺环素(Minocycline hydrochloride),可在不影响细胞状态的前提下,有效抑制和清除在细胞培养中广泛存在的支原体污染,对于常见的革兰氏阴性和阳性菌也有一定的清除作用。 |
| 青霉/链霉素双抗溶液
Penicillin-Streptomycin (100×), Sterile 是已过滤除菌,可直接用于细胞培养的双抗溶液。 |